Wirkungslose Helferzellen
Das Protein IKBNS hat eine besondere Bedeutung bei der Entstehung von Immunzellen: Vor zwei Jahren konnte die Arbeitsgruppe „System-orientierte Immunologie und Entzündungsforschung“ von Prof. Ingo Schmitz zeigen, dass sich regulatorische T-Zellen, sogenannte Tregs, nicht bilden, wenn dieses Protein fehlt. Die Arbeitsgruppe Schmitz ist eine Kooperationseinheit der Otto-von-Guericke-Universität in Magdeburg und dem Helmholtz-Zentrum für Infektionsforschung in Braunschweig. Nun hat die AG Schmitz entdeckt, dass IKBNS auch bei der Entwicklung einer weiteren Zellart, den Th17-Zellen, eine Rolle spielt. Th17-Zellen werden zwar auch in Abwesenheit des Proteins gebildet, sie können aber ihre Wirkung nicht entfalten. Langfristig könnten die im „Journal of Immunology“ veröffentlichten Ergebnisse bei der Behandlung von Autoimmunkrankheiten helfen.
 T-Zellen sind eine Gruppe der weißen Blutkörperchen, die einen wichtigen Beitrag zur körpereigenen Immunantwort leisten. Dabei gibt es verschiedene Typen von T-Zellen, die bei der Immunreaktion unterschiedliche Funktionen einnehmen. Die sogenannten T-Helferzellen steuern beispielsweise die Immunantwort, indem sie das Wachstum und die Ausbildung von Immunzellen anregen. Dies geschieht über die Ausschüttung von besonderen Botenstoffen, den Zytokinen. Eine besondere Form dieser T-Helferzellen sind die sogenannten Th17-Zellen, die das Zytokin Interleukin-17 produzieren.
T-Zellen sind eine Gruppe der weißen Blutkörperchen, die einen wichtigen Beitrag zur körpereigenen Immunantwort leisten. Dabei gibt es verschiedene Typen von T-Zellen, die bei der Immunreaktion unterschiedliche Funktionen einnehmen. Die sogenannten T-Helferzellen steuern beispielsweise die Immunantwort, indem sie das Wachstum und die Ausbildung von Immunzellen anregen. Dies geschieht über die Ausschüttung von besonderen Botenstoffen, den Zytokinen. Eine besondere Form dieser T-Helferzellen sind die sogenannten Th17-Zellen, die das Zytokin Interleukin-17 produzieren.
Diese Zellen spielen zum einen eine wichtige Rolle bei der Abwehr extrazellulärer Pathogene wie beispielsweise Bakterien, können aber auf der anderen Seite auch einen negativen Effekt haben. „Bei Autoimmunkrankheiten fördern sie die Schädigung des Gewebes“, sagt Prof. Ingo Schmitz. „Deshalb ist es spannend zu erfahren, wie genau und wodurch sie gebildet werden“.
Bei der Suche nach der Lösung verfolgte er, gemeinsam mit Kollegen vom Twincore in Hannover und der Charité in Berlin, einen bereits von anderen T-Zellen bekannten Ansatz. „Wir haben vor zwei Jahren zeigen können, dass das Protein IKBNS eine Schlüsselrolle bei der Entstehung von Tregs spielt“, sagt Schmitz. Schaltet man das Protein aus, werden keine Tregs mehr produziert. Sie regulieren die Immunantwort nicht mehr und es kommt im schlimmsten Fall zu erheblichen Überreaktionen des Abwehrsystems. Die Ergebnisse der Forscher zeigen: Bei Th17-Zellen ist das anders.
„Selbst wenn IKBNS komplett ausgeschaltet wird, können sich die Th17-Zellen noch ausbilden. Wir konnten aber beobachten, dass sich die Zellen langsamer vermehren und insgesamt weniger Zytokine produzieren“, sagt Schmitz. Das wirkt sich auf die Effektivität der Th17-Zellen aus: War IKBNS im Mausmodell abgeschaltet, entwickelten sich während einer chronischen Darmentzündung keine Th17 Zellen mehr. Außerdem fiel die Immunantwort gegenüber Citrobacter rodentium, das mit human-pathogenen E. coli-Bakterien verwandt ist, vermindert aus und die Bakterien überlebten.
Während IKBNS also anders als bei den Tregs nicht allein für die Ausbildung von Th17-Zellen verantwortlich ist, nimmt es dennoch entscheidenden Einfluss auf die Funktionsfähigkeit der Immunzellen.
 „Langfristig könnten uns diese Erkenntnisse dabei helfen, Ansatzpunkte für die Bekämpfung von Autoimmun- und Infektionskrankheiten zu finden. Wenn es gelingt, IKBNS gezielt in bestimmten T-Zellen zu manipulieren, könnte man die Immunantwort so maßschneidern, dass die entsprechende Infektion beziehungsweise Autoimmunkrankheit bekämpft wird“, sagt Schmitz. Daran wird im Rahmen des an der Otto-von-Guericke-Universität Magdeburg ansässigen Sonderforschungsbereichs „Molekulare Organisation der zellulären Kommunikation im Immunsystem“ (SFB 854) weiter geforscht.
„Langfristig könnten uns diese Erkenntnisse dabei helfen, Ansatzpunkte für die Bekämpfung von Autoimmun- und Infektionskrankheiten zu finden. Wenn es gelingt, IKBNS gezielt in bestimmten T-Zellen zu manipulieren, könnte man die Immunantwort so maßschneidern, dass die entsprechende Infektion beziehungsweise Autoimmunkrankheit bekämpft wird“, sagt Schmitz. Daran wird im Rahmen des an der Otto-von-Guericke-Universität Magdeburg ansässigen Sonderforschungsbereichs „Molekulare Organisation der zellulären Kommunikation im Immunsystem“ (SFB 854) weiter geforscht.
Originalpublikation:
Annemann M, Wang Z, Plaza-Sirvent C, Glauben R, Schuster M, Ewald Sander F, Mamareli P, Kühl AA, Siegmund B, Lochner M, Schmitz I.
IκBNS Regulates Murine Th17 Differentiation during Gut Inflammation and Infection. The Journal of Immunology, DOI: 10.4049/jimmunol.1401964.
Die Arbeitsgruppe „SYSTEMORIENTIERTE IMMUNOLOGIE UND ENTZÜNDUNGSFORSCHUNG“ erforscht molekulare Prozesse in Immunzellen, die diese tolerant gegenüber dem eigenen Körper machen. Dazu zählt das „Selbstmordprogramm“ Apoptose und der Transkriptionsfaktor NF-kB.
DAS HELMHOLTZ-ZENTRUM FÜR INFEKTIONSFORSCHUNG:
Am Helmholtz-Zentrum für Infektionsforschung (HZI) untersuchen Wissenschaftler die Mechanismen von Infektionen und ihrer Abwehr. Was Bakterien oder Viren zu Krankheitserregern macht: Das zu verstehen soll den Schlüssel zur Entwicklung neuer Medikamente und Impfstoffe liefern. Am seinem Standort in Braunschweig-Stöckheim blickt das Zentrum auf eine jahrzehntelange Historie zurück. Bereits 1965 begannen hier die ersten Arbeiten; 2015 feiert das HZI 50-jähriges Jubiläum.
DIE OTTO-VON-GUERICKE-UNIVERSITÄT MAGDEBURG:
Einer der Forschungsschwerpunkte der Medizinischen Fakultät der Otto-von-Guericke-Universität Magdeburg ist „Immunologie einschließlich Molekulare Medizin der Entzündung“. Ziel ist die Entwicklung neuer Therapien und die Umsetzung für den Patienten.
FOTO 1: Die beiden Magdeburger Autoren Dr. Michaela Annemann, Erstautorin der Studie, und Prof. Dr. Ingo Schmitz, der die Studie geleitet hat.
Foto: Melitta Dybiona
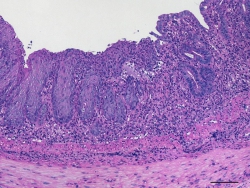
FOTO 2: Die Infiltration von Immunzellen in die Schleimhaut des Dickdarms einer Maus wurde nach chemisch-induzierter Kolitis mittels Hematoxylin und Eosin Färbung nachgewiesen.
Foto: Dr. Anja A. Kühl





